Tamizaje Molecular en el Contexto de la Seguridad Transfusional
martes 31 octubre 2023

Tamizaje Molecular en el Contexto de la Seguridad Transfusional con Enfoque de Riesgo
Resumen
La seguridad transfusional se ha fortalecido en las últimas cuatro décadas por el avance en la cultura de la donación voluntaria y no renumerada, acompañada de la mejora en las plataformas de tamizaje para la detección especifica de agentes microbiológicos en donantes; sin embargo, a pesar de estas medidas de seguridad persiste el riesgo de infecciones transmitidas por transfusiones. Además, este riesgo es debido principalmente a las donaciones de sangre captadas durante el período de ventana inmunológica. Por lo tanto, una estimación precisa del riesgo de infección viral por transfusión ayudará a determinar el efecto de cada medida de seguridad nueva y vigente, así como la priorización y asignación de recursos, en especial en países de bajo a medianos ingresos. Finalmente, esta revisión busca describir las características analíticas, ventajas y limitaciones del tamizaje molecular dentro del contexto de la seguridad transfusional de estos países con limitados recursos económicos.
Palabras Claves: Ácidos nucleicos, Seguridad de la Sangre, Donantes de Sangre, Toma de Decisiones Key Words: Nucleic Acids, Blood Safety, Blood Donors, Decision Making
Introducción
En los últimos 40 años, se han implementado barreras de seguridad adicionales a los criterios de selección de donantes y al fomento de la cultura de la donación de sangre altruista, voluntaria y habitual. Por lo tanto, el énfasis de tener la más alta seguridad transfusional, basados en el paradigma del “cero riesgo” (en inglés, “Zero Risk”); surgido en la década de los 90´s del siglo XX y generado a partir del “principio de precaución” en salud pública adaptado a las transfusiones de sangre (Allain & Goodrich, 2017; Foster et al., 2000); para mitigar al mínimo las infecciones transmitidos por la transfusión (ITT), ha permitido diseñar varias estrategias, entre los cuales se tienen: a) tamizaje serológico, b) el cultivo bacteriano (control microbiológico, en algunos sistemas nacionales de sangre del 100% a los componentes plaquetarios), c) el tamizaje molecular, d) la leucodepleción y e) las tecnologías de reducción de patógenos (en inglés, PRT) / inactivación de leucocitos. Sin embargo, estas medidas son complementarias y en algunas situaciones pueden ser redundantes en la mitigación de algunos agentes infecciones superponen, y que el objetivo final del riesgo cero para ITT probablemente no sea alcanzable, porque queda el riesgo latente de las infecciones transmitidas por proteínas infecciosas como los “Priones” causantes de la variante de la Enfermedad de Creutzfeldt-Jakob (en inglés, vCJD) los cuales aún no cuentan con métodos de tamizaje poblacional y los donantes son un riesgo potencial relacionado a la ventana inmunológica, los cuales pueden identificarse como falsos negativos debido a las limitantes analíticas de todas las estrategias previamente mencionadas (Hans & Marwaha, 2014; Yonemura et al., 2017a).
Desde la perspectiva del panorama previo, existe otro riesgo en la sostenibilidad en el tiempo de los Sistemas Nacionales de Sangre (SNS), el cual corresponde al financiero, debido a los costos ascendentes en la implementación de estas tecnologías durante la preparación y obtención de componentes sanguíneos, sumado a un ambiente local de regulación laxa por parte de los entes gubernamentales (WHO, 2021). Por lo tanto, para controlar este riesgo financiero se requiere del empoderamiento de estos entes, a través de la gobernanza y la construcción de redes locales de conocimiento en medicina transfusional, así como la articulación entre los diferentes actores como aseguradores, centros sanitarios, bancos de sangre y organizaciones gubernamentales como los ministerios de salud, para generar análisis costo-beneficio en la implementación de estas tecnologías; como se observa en la figura 1; buscando medir el mayor impacto positivo de cada estrategia en la seguridad transfusional de los receptores, de acuerdo con la caracterización epidemiológica de los mismos y el perfil de riesgo en la población universal de los donantes potenciales. Por consiguiente, esta revisión busca describir las ventajas y limitaciones del tamizaje molecular dentro del contexto de la seguridad transfusional en países con limitados recursos económicos.
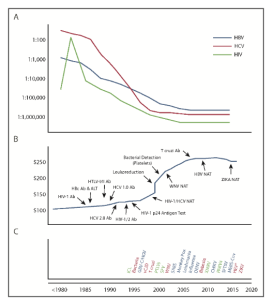
Figura 1. Descripción durante 40 años de las principales intervenciones de ITT y los costos asociados en Estados Unidos (EU).
Tomado de (Busch et al., 2019).
En la sección (A), Riesgo de infección por componente de VHB, VHC y VIH de 1980 a 2018. (B) Relación temporal de las intervenciones progresivas para reducir los riesgos de ITT con la tarifa promedio de servicio para la adquisición de componentes de glóbulos rojos de organizaciones de recolección de sangre en los Estados Unidos (EU). En la sección (C) Posibles agentes infecciosos emergentes de ITT que se investigaron durante los últimos 25 años. El rojo oscuro se indica los agentes que han demostrado ser amenazas a la seguridad de la sangre para los que se implementaron intervenciones; en azul, los agentes establecidos para ITT solamente diferidos por encuesta sin intervención adicional; y en verde, posibles amenazas.
Método
Para lograr objetivo propuesto de revisión se revisó el repositorio digital de la Librería Nacional de Medicina (en inglés, National Library of Medicine) disponible en el WebSite PubMed.gov del Instituto Nacional de Salud (en inglés, NIH) de Estados Unidos de América (EUA). Por lo tanto, se emplearon los siguientes descriptores: 1) términos de búsqueda estandarizados (en inglés, MeSH: Medical Subject Headings); 2) Revisiones de la literatura, metaanálisis y estudios de cohorte; 3) publicados en los últimos 10 años; 4) reportes en humanos; y disponibles en texto completo en otras bases de datos como EBSCO®, entre otras. A continuación, se describe los criterios de búsqueda [ ((“Nucleic acid testing[MeSH Terms]”[All Fields]) AND (“blood donors”[MeSH Terms] OR (“blood”[All Fields] AND “donors”[All Fields]) OR “blood donors”[All Fields])) AND ((randomizedcontrolledtrial[Filter] OR review[Filter] OR systematicreview[Filter]) AND (2011:2021[pdat]))], lo cual se obtuvieron 31 referencias indexadas de las cuales se emplearon las más relevantes para este revisión.
Desarrollo y discusión
Diagnóstico situacional
La Organización Mundial de la Salud (OMS; en inglés, WHO), ha establecido dentro de sus objetivos estratégicos, en el marco de acción para promover el acceso universal a productos sanguíneos seguros, efectivos y de calidad garantizada 2020-2023 buscando la gestión eficiente de los servicios de sangre(WHO, 2021).
Por lo tanto, OMS recomienda para garantizar un abastecimiento sostenible y oportuno de componentes sanguíneos dentro de un sistema nacional de atención sanitaria, un marco legal de gobernanza entre los actores de la red de sangre buscando dos objetivos: a) la coordinación y el financiamiento estable del sistema sanguíneo; y b) cumplimiento uniforme de las normas reconocidas internacionalmente para la calidad y seguridad de los productos sanguíneos (WHO, 2021; World Health Organization, 2010).
Por lo tanto, para lograr estos objetivos de unos componentes seguros, se ha propuesto varias estrategias para mitigar al mínimo el riesgo de ITT en los eventos transfusionales. Dentro de estos, se describen el cribado o tamizaje serológico de preferencias con plataformas de diagnóstico in vitro (en inglés, IVD) tipo inmunoensayos enzimáticos (en inglés, ELISA) que detecten antígenos, anticuerpos totales o la combinación de anticuerpos y antígenos para agentes infecciosos específicos que potencialmente puedan ser ITT (Allain & Goodrich, 2017). Estas pruebas han mejorado progresivamente hasta alcanzar altos niveles de rendimiento, aunque sigue siendo necesaria la confirmación con ensayos complementarios específicos o la repetición del tamizaje serológico con ensayos alternativos, especialmente en los países en desarrollo de alta prevalencia (World Health Organization, 2010).
Esta limitante analítica de las pruebas serológicas ha llevado a que países desarrollados y en algunos países de ingresos medios (en inglés, Middle-Income Country, MIC) como India, China o Sudáfrica; implementar pruebas de ácido nucleico (en inglés, NAT) para agentes infecciosos de tipo viral como Virus de Inmunodeficiencia Humana (VIH; en inglés, HIV), agentes virales hepatotrópicos como los virus de la hepatitis tipo B (VHB; en inglés, HBV) y C (VHC; en inglés, HCV), así como otros potenciales para ITT tales como el virus del Nilo Occidental, el virus del dengue o el virus Zika (World Health Organization, 2010; Yonemura et al., 2017a). Sin embargo, existe otro grupo de virus potenciales ITT que no cuentan con pruebas de tamizaje molecular, por lo cual se implementado la leucodepleción prealmacenamiento o en cabecera de cama para mitigar virus intracelulares, tales como el virus linfotrópico T humano (en inglés, HTLV)-I/II, citomegalovirus (CMV), Virus de Epstein-Barr (EBV) y Virus del Herpes Humano (HHV)-8 (Silvergleid, 2021); pero esta estrategia no reduce este riesgo por si solo y debe complementarse con la estrategia de mayor facilidad de implementación, el diferimiento por encuesta para los donantes potencial con alta carga viral específico para estos agentes (Leparc, 2015; Maghsudlu et al., 2021; WHO, 2012).
Pero estos lineamientos no se cumplen de forma sistemática y estandarizada a nivel mundial. Según, la OMS para el 2015, en la encuesta mundial sobre seguridad sanguínea (en inglés, Global Database on Blood Safety, GDBS), 66 de los 173 países participantes (38%) informaron una tasa anual de donación de sangre inferior a la que generalmente se considera como el mínimo necesario para cumplir con los requisitos básicos de sangre (WHO, 2021; Yonemura et al., 2017b). Por lo tanto, los países de ingresos altos con sistemas de salud bien estructurados y programas de sangre basados en donantes de sangre voluntarios no remunerados suelen satisfacer la demanda de hemoderivados. Por el contrario, en los países de ingresos bajos y medianos (en inglés, Low and Middle-Income Country: LMIC), la escasez de sangre es común. En estos países a menudo no tienen programas estructurados de donantes de sangre y como resultado, no pueden retener un número suficiente de donantes para satisfacer la necesidad de sangre en emergencias, en cirugía planificada y transfusión regular. De las 117,4 millones donaciones de sangre recolectadas en todo el mundo para ese año, el 42% se recolectaron en países de altos ingresos, que comprenden solo el 16% de la población mundial. Por lo tanto, el 58 (34%) de los 173 países que respondieron al GDBS 2015 dependen de donaciones familiares o de reemplazo, así como de donaciones pagadas para cubrir más del 50% de las necesidades de sangre de su población (WHO, 2021). Lo anterior, es debido en parte a la falta de compromiso de algunos gobiernos con un SNS coordinado a nivel nacional que optimice los recursos para su adecuado funcionamiento. Así mismo, se refleja en otros aspectos en la preparación y componentes seguros. En esa misma encuesta, 149 (86%) países informaron que cuenta con estándares establecimientos para la preparación de componentes sanguíneos, 118 (68%) países reportaron la existencia de esquemas nacionales de evaluación externa de la calidad para las pruebas de tamizaje para ITT y 104 (60%) países informaron de la existencia de evaluaciones nacionales externas de serología de grupos sanguíneos y pruebas de compatibilidad (WHO, 2021). Basados en este diagnóstico situacional a nivel global, se hace necesario en los países LMIC; además de contar con una gobernanza entre los actores del sistema; la implementación sistemática y progresiva de las estrategias para la mitigación de ITT que fueron citadas en los párrafos previos.
Medición del Riesgo de ITT en el contexto de la Medicina Transfusional
Otro aspecto importante es definir las características de un riesgo potencial de ITT, para ello la OMS ha definido como un agente infeccioso con capacidad para circular en la población universal de donantes potenciales, así mismo este presente en sangre periférica por largos periodos de tiempo acompañados de formar asintomática; que tenga la capacidad de ser viable y potencial patógeno a pesar de la preservación (crio o refrigeración); y finalmente al transfundirse el componente sanguíneo tenga la capacidad de generar enfermedad en el receptor (Busch et al., 2019; Claudio Velati et al., 2018; World Health Organization, 2010).
Así mismo, existen otros factores analíticos y propios del comportamiento que deben tomarse en cuenta en el momento de realizar los análisis costos beneficio para la implementación de estrategias en el tamizaje de donantes tales como el Riesgo Residual de Infección (RRI), el cual es definido por la OMS como la probabilidad que aún realizando las pruebas de tamización para agentes infecciosos al donante, se capta un donante asintomático con viremia infectado por un agente con potencial de transmisión transfusional y no fue detectado por el tamizaje de rutina (World Health Organization, 2016, 2017). Sin embargo, esta medición por si misma requiere de otros aspectos analíticos como: sensibilidad analítica, sensibilidad diagnóstica y las características epidemiológicas de la circulación del agente infeccioso en una población global de donantes potenciales en un territorio tales como prevalencia e incidencia (World Health Organization, 2016). Por lo tanto, la sensibilidad analítica (en inglés, Limit of Detection: LoD) corresponde a la cantidad mínima del marcador objetivo que puede ser detectada por ensayo IVD (Armbruster & Pry, 2008); la sensibilidad diagnóstica hace referencia a la probabilidad que un ensayo resulte positivo en muestras que contienen el marcador objetivo (Verdaderos Positivos) (Armbruster & Pry, 2008; World Health Organization, 2016); la prevalencia corresponde a la proporción de infecciones pasadas identificadas en un periodo de tiempo en una población y finalmente, incidencia corresponde al número de casos o infecciones adquiridas de nuevo por unidad de tiempo en una población (World Health Organization, 2017).
Además, del RRI existen otros conceptos importantes con el periodo de ventana inmunológica. Por lo tanto, este periodo se define como el intervalo entre el momento en que el donante se expone inicialmente a un agente microbiológico con capacidad de generar una infección y el momento en que las pruebas analíticas específica de tamizaje pueden detectar una infección en su fase preclínica (Stramer & Galel, 2017). Por lo tanto, los componentes preparados de donantes aceptados durante el “período de ventana” se liberan con todas las pruebas de detección no reactivas, pero podrían potencialmente transmitir una infección (Kleinman, 2021; Stramer & Galel, 2017; World Health Organization, 2010). Sin embargo, para mitigar este riesgo, se establecen los criterios de selección de donantes y la encuesta al donante, porque los tiempos de diferimiento permiten excluir aquellos donantes potenciales con posible exposición a agentes infecciosos y proteger al receptor de estos.
Características analíticas de las pruebas de tamizaje molecular en donantes voluntarios.
La reacción en cadena de la polimerasa (en inglés, PCR) fue diseñada por Kary Mullis, cuya implementación llevo a este mismo al galardón del premio Nobel (Roth, 2019; Saiki et al., 1985). Sin embargo, la desventaja de la primera versión de PCR fue la necesidad de volver a abrir los tubos de muestra después de la amplificación por electroforesis en gel. Esto requería mucho tiempo y existía un riesgo asociado de contaminación cruzada entre diferentes muestras. Además, esta versión de PCR solo era factible para el análisis de muestras individuales y operativamente no era factible para procesar grandes volúmenes o lotes de donantes aceptados de sangre (Roth, 2019; Saiki et al., 1985). Otro problema, fue que se requería mucho tiempo y existía un riesgo asociado de contaminación cruzada entre diferentes muestras.
Con el avance de la tecnología PCR, se inició el procesamiento de oligonucleótidos (aproximadamente 20 pares de bases de nucleótidos) marcados con dos fluorocromos, capaces de absorber y emitir luz en diferentes longitudes de onda, este avance con el desarrollo de una nueva generación de enzimas facilitó los procedimientos de un solo paso para la amplificación de ADN y ARN (incluido un paso de transcripción inversa) (Roth et al., 1999; Schmidt & Seifried, 2010).
Posteriormente, con la mejora estas plataformas moleculares como la introducción del método de PCR en tiempo real (en inglés, RT-PCR), permitió la automatización y redujo significativamente sus inconvenientes inherentes o incluso se eliminaron, por ejemplo, la contaminación en los biocatalizadores y en los sustratos, así como en los productos de amplificación (ampliaciones) (Higuchi et al., 1992). Otro aspecto fueron los controles internos, los cuales se incluyeron y se discriminaron fácilmente de las secuencias diana marcando con diferentes fluorocromos para PCR (Roth, 2019). Adicionalmente, con la estandarización de la multiplexación de las PCR, para varios virus diferentes se pudo detectar en paralelo con una sola prueba y discriminarse entre sí mediante diferentes marcadores. Otro aspecto analítico, fue la estandarización de “minipools” (Chaitanya Kumar et al., 2020), lo cual optimizo los costos basados en un modelo de escala. Por consiguiente, con la automatización y estandarización de esta tecnología de tamizaje, se hizo accesible, mejoró la sensibilidad y la especificidad junto con el mayor rendimiento aun costo razonable (Chaitanya Kumar et al., 2020; Roth, 2019). A continuación, se describen las bases analíticas de las técnicas de amplificación medida por transcripción (en inglés, TMA) y otras metódicas de RT- PCR
Por consiguiente, la técnica de TMA usa amplificaciones de porciones de ARN y / o ADN. La transcriptasa inversa crea una copia de ADN (en inglés, ADNc) del ácido nucleico diana. La ARN polimerasa inicia la transcripción y síntesis de ARN. Algunos de los productos de amplificación de ARN recién sintetizados vuelven a entrar en el proceso de TMA y sirven como plantillas para nuevas rondas de amplificación. El proceso de amplificación está mediado por un promotor T7. Se producen más de 1000 productos de amplificación en un ciclo y potencialmente se generan miles de millones de copias en <1 h. La detección se lleva a cabo mediante sondas marcadas con éster de acridinio (EA) hibridadas específicamente con los productos de amplificación. Además, se utilizan diferentes variantes de EA para etiquetar las sondas específicas de control interno y específicas de virus. El proceso de ensayo de protección de hibridación inactiva selectivamente el marcador AE en sondas sin hibridar para minimizar la señal de fondo. La tecnología de ensayo de doble cinética permite la detección simultánea de ARN codificado por el control interno y ARN codificado por virus, a través de una señal más intensa y duradera (Roth, 2019; Schmidt & Seifried, 2010).
De otro lado, las tecnologías de RT-PCR emplean el mismo principio de este grupo de técnicas, todos los sistemas utilizan al menos un cebador sentido, un cebador antisentido y cualquier tipo de sonda, enzima y nucleótido. Estos sistemas, por lo menos emplean sondas específicas marcadas con uno o dos fluorocromos. Durante la amplificación, la ADN polimerasa también actúa como exonucleasa. Por lo tanto, las sondas unidas al objetivo pueden degradarse y la distancia entre ambos tintes puede aumentarse. Esto cambia la transferencia de energía entre el tinte indicador y el tinte apagador. Los sistemas NAT clásicos en tiempo real están disponibles como ensayos TaqMan® con sondas TaqMan® (sondas de hidrólisis) o con sondas de hibridación. Se marcan dos pequeñas sondas de hibridación, cada una con un colorante.
Basado en el principio anterior, se implementaron diferentes plataformas de IVD, una de ellas es la prueba de ácido nucleico (en inglés, NAT) correspondiente a una técnica molecular para la detección de donaciones de sangre para reducir el riesgo de ITT en los receptores, lo cual ha proporcionado en las últimas tres décadas contadas como una barrera adicional de seguridad en el ciclo de la sangre (Hans & Marwaha, 2014; Roth, 2019).
Por lo tanto, existe una diferencia entre la pruebas de RT-PCR cuantitativas y las cualitativas, estas últimas suelen ser más sensibles en el cribado de la población global de donantes potenciales que las pruebas cuantitativas cuyo desempeño es mucho mejor en el contexto clínico de un paciente en fase clínica (Schmidt & Seifried, 2010; Stramer & Galel, 2017). Por lo tanto, una prueba NAT para VIH-1 puede detectar con LoD de 25,7 UI/mL mientras que una prueba cuantitativa es positiva con un LoD de 69,6 UI/mL (Kleinman, 2021). De igual forma se observa en la HBV y HCV.
Además, un aspecto importante mencionar ha sido la curva de mejora en la detección de los donantes reactivos para pruebas NAT en agrupación o en inglés “pools”, el cual impacta positivamente en la eficiencia del tamizaje en términos costo-beneficio desde la perspectiva de economía de la salud. Sin embargo, algunos países debido a su estructura de Sistema Nacional de Sangre (SNS), cuentan con una red pequeña de Bancos de Sangre, los cuales procesan la totalidad de los componentes que se transfunden en un país. En estos SNS cuya centralización, realizaban analítica de tamizaje hasta de 10.000 muestras diarias. Por lo tanto, el procesamiento de este gran volumen de muestras diarias representó un gran desafío a inicios del siglo XXI, lo cual se generó la iniciativa de agrupar las muestras en “pools”, así por ejemplo país como Japón comenzaron en 1999 con minigrupos de hasta 500 muestras por pools para el VHB, el VHC y el VIH-1 (Mine et al., 2003). Sin embargo, otros SNS como Alemania, entre 1996-1997, desarrollaron sistemas de minigrupos; en inglés, “mini-pools” (MP); MP-NAT hasta un máximo de 96 muestras de donantes (Roth, 2019; Roth & Seifried, 2002). Posteriormente, en la primera década del siglo XXI, se inicia el tamizaje molecular de donantes por plataformas IVD comerciales, se integraron equipos de preanalítica para realización automatizada de los MP-NAT y se iniciaron la disminución progresiva del tamaño de los a 16, 8 o 6 (Roth, 2019; Schmidt & Seifried, 2010). Estos avances permitieron que los MP-NAT no mostraran diferencias analíticas importantes frente a los análisis individuales por donante (en inglés, ID-NAT), generando optimización en la analítica de los donantes aceptados al no afectar la liberación oportuna de los componentes al Servicio Transfusional (ST) y disminución de los costes por esta pruebas de tamizaje (Panhotra et al., 2005). Otro avance importante fue en los inicios de la segunda década del siglo XXI, el cual correspondió a la implementación de un reactivo IVD multiplex para tamizaje simultaneo de HIV, HCV y HBV (Fiedler et al., 2019).
¿Por qué se introdujo el tamizaje molecular en la seguridad transfusional?
La seguridad transfusional entro en un grave riesgo reputacional, cuando en la década de los 80’s del siglo XX, se comenzó a documentar la transmisión de la infección por VIH en receptores con historial de transfusión múltiple como los pacientes hemofílicos, observándose en estos mismo en poblaciones clave o con riesgo mayor al poblacional por una mayor prevalencia de infección por VIH comparada con la población general, en mismo sitio geográfico y temporalidad (Kim et al., 2012). Adicionalmente, a finales de esa misma década, se presentaron reportes de receptores que manifestaron hepatitis aguda de origen viral del tipo no A-no B postransfusión, que posteriormente fueron caracterizadas por altos títulos de anticuerpos contra el HCV (Kim et al., 2012; Roth, 2019). Por lo cual, se observaron elevadas tasas que fueron similares hasta el 80% en hemofílicos(Roth et al., 1999). Por consiguiente, a mediados de la década de 90’s del siglo XX, el riesgo residual de infección por VHC asociada a transfusiones se estimó alrededor del 1 en 5000 componentes (Schmidt & Seifried, 2010).
Teniendo este contexto epidemiológico identificado en los donantes potencial y con la implementación de la tecnología PCR, se inició el desarrollo e implementaron otras metódicas más sensibles que las pruebas serológicas de rutina. Una de estas fue planteada por el Servicio de donantes de sangre de la Cruz Roja Alemana en Frankfurt (Alemania) a mediados de 1990, a través del desarrolló una prueba interna (en inglés, “in house”) y fue la primera institución sanitaria en publicar la viabilidad y eficiencia de la detección de donantes de sangre con tecnología NAT para VIH, VHB y VHC (Roth et al., 1999; Schmidt & Seifried, 2010).
Por lo tanto, con la automatización de esta plataforma de tamizaje molecular, para la ITT por VHC se redujo el período de ventana entre 4 a 6 días (Schmidt & Seifried, 2010). Esto ha dado lugar a un riesgo residual de ITT de menos de 1 por 1 millón de componentes transfundidos para el VHC y el VIH-1 en los países que utilizan NAT(Roth, 2019).
Sin embargo, el principal impacto y valor agregado de las pruebas de tamizaje molecular dentro de la cadena de seguridad transfusional es una mayor sensibilidad en la detección de Infección Oculta por HBV (en inglés, OBI)(C. Velati, 2010). Este punto es importante recalcar porque no es solo la disminución de la ventana inmunológica, sino la capacidad de diferir permanentemente aquellos donantes potenciales de interés en salud pública que lo realizan fuera del contexto altruista y no son donantes seguros, sino por el contrario están más expuestos a agentes infecciosos potenciales de ITT que la población general, así como aquellos que durante el proceso de selección en la entrevista podrían pasar estos riesgos de forma desapercibida. Adicionalmente, el tamizaje molecular es un complemento al serológico, dado que este último tiene un mayor espectro de agentes potenciales de ITT como bacterias o parásitos intracelular y a la PRT, porque esta última como las anteriores tiene limitantes analíticas y es importante tener en claro que es una reducción importante de la carga infecciosa pero no en la eliminación total de un componente sanguíneo a riesgo proveniente de un donante aceptado con alta carga infecciosa (Bah et al., 2018).
Consideraciones para la toma de decisiones incluyendo la economía de la salud
Debido a las crisis de incertidumbre de ITT en los donantes, por el riesgo de HIV en la década de los 80’s y el HCV en la década de los 90’s, en muchos países han basado sus políticas de seguridad de la sangre en un paradigma de precaución. Sin embargo, los riesgos financieros de sostenibilidad de SNS, se han desarrollo experiencias para limitar mejor el concepto de precaución en seguridad transfusional. Para ello se han implementado metodologías para definir un riesgo transfusional con una sostenibilidad razonable, para ello se requiere caracterizar el riesgo, posteriormente se puede definir un nivel de riesgo tolerable, equilibrando la seguridad del receptor, la disponibilidad de sangre, el coste de analítica, la oportunidad en el suministro de la sangre y otras preocupaciones de las partes interesadas como los médicos solicitantes, en especial los relacionados para mitigar las reacciones adversas asociadas a la transfusión (RAT)(Busch et al., 2019).
Teniendo en cuenta las variables previamente expuestas, se han realizo ejercicios en conjunto con el Instituto Nacional del Corazón, los Pulmones y la Sangre de los Estados Unidos de América (en inglés, US National Heart, Lung, and Blood Institute, NHLBI), la Asociación para el Avance de la Sangre y las Bioterapias (anteriormente conocida como la Asociación Americana de bancos de sangre. En inglés, Association for the Advancement of Blood & Biotherapies, AABB) y con la Administración de Alimentos y Medicamentos de los Estados Unidos (en inglés, FDA) desarrollando el proceso de “Toma de decisiones basada en el riesgo” (en inglés, “Risk Based Decision Making”, RBDM) (Leach Bennett & Devine, 2018). Este proceso incluye un método formalizado para cuantificar el riesgo y evaluar las intervenciones(Klein et al., 2017). Así mismo, incluye la obtención de las opiniones de las partes interesadas.
Por lo tanto, a través de otras empleadas por la economía en salud, entre estas los análisis costo-efectividad (ACE), se han calculado en muchas intervenciones de intervenciones para mitigar el riesgo de ITT (Custer & Hoch, 2009). Por consiguiente, la adopción inicial del tamizaje serológico de los virus implicados en ITT de interés en salud pública como HIV, HBV y HBC; supuso un ahorro de costes, mientras que la incorporación de pruebas adicionales como el Virus del Rio Nilo Occidente (en inglés, WNV), Virus del Zika (en inglés, ZKV), en otros, han sido progresivos la inclusión de pruebas NAT y otros agentes menos prevalentes, se han relacionado con análisis costo-efectividad menos eficientes, con menor impacto los SNS, lo cual ha significado un aumentan significativamente el costes de la preparación de componentes (Custer & Hoch, 2009; Klein et al., 2017). Una vez finalizado la determinación de los estudios costo-efectividad, los actores de un SNS, encabeza del ente de gobernanza deben generar una recomendación razonable en búsqueda de la sostenibilidad financiera y con un impacto positivo para la seguridad del receptor, así como algunas decisiones de adopción se han considerado aceptables para mantener la confianza de la población en general con respecto a la seguridad de la sangre; un ejemplo, son análisis costo-efectividad para NAT tanto para VIH, VHC,VHB y WNV tiene un impacto positivo alrededor de unos US$ 1.3 millones por años de vida ajustados por calidad (AVAC; en inglés, Quality-adjusted life year, QALY)(Busch et al., 2019).
Para el 2017, en Colombia se realizó un ACE, buscando evaluar el impacto de la adición de pruebas NAT de VHB, VHC y VIH al tamizaje serológico en donaciones de sangre, buscando estimar la reducción del riesgo ITT en receptores de componentes sanguíneos. Por lo tanto, esta alternativa reduciría el número de personas que reciben donaciones infectadas y en el largo plazo, pudieran desarrollar clínicamente una infección por HIV, HBV y HCV, lo cual potencialmente mejorar la seguridad del suministro de sangre en el país. Así mismo, implementar pruebas NAT individual salvaría 69,80 AVAC anualmente (1396,07 AVAC acumulados en el horizonte temporal) y disminuiría el costo en COP$2.476.628.869,43 anualmente (COP$35.480.021 ahorro acumulado en el horizonte temporal de 20 años) para el Sistema General de Seguridad Social en Salud (Vera Cala et al., 2018). Esto podría indicar que la adición de pruebas NAT a los protocolos convencionales es una estrategia costo-efectiva para el SNS colombiano (Duarte et al., 2015). Sin embargo, los encargados del gasto deben analizarse y ajustar sus conclusiones del ACE, al modelo económico y sanitario de cada Banco de Sangre (BS), así como al perfil epidemiológico de los receptores del ST a los cuales el BS distribuye.
Finalmente, es importante tener en claro que las medidas de seguridad transfusional deben evaluarse con periodicidad, dado que una vez implementadas estas barreras de seguridad rara vez se abandonan. Por lo tanto, se requiere de un enfoque integral e imparcial con la participación en conjunto de todos los actores, así como una metodología estandarizada, para realizar una evaluación integral de los ensayos y nuevas tecnologías que mejoran las estrategias existentes, con el objetivo de reemplazar en lugar de agregar a las medidas de seguridad existentes.
Conclusión
El tamizaje molecular en donantes voluntarios y altruista es una barrera de seguridad complementario a los criterios de selección de donantes y a las pruebas serológicas normativas. Sin embargo, esta medida es mas eficiente a nivel de salud pública, si es alta la prevalencia del agente específico en la población general de donantes potenciales; por ejemplo, en el contexto colombiano las correspondiente a la infección por HBV o de la HCV. Pero se deben realizarse con regularidad la evaluación de las medidas de seguridad transfusional, buscando de acuerdo con el perfil epidemiológico de donantes como de los receptores, identificar la medida con mayor impacto desde los ACE y con viabilidad de su implementación rápida, así como universal para todos los receptores. Por lo tanto, los actores del SNS de forma coordinada deben diseñar una metodología de riesgo razonable dentro del contexto de medicina transfusional de cada institución sanitaria articulada con el modelo de atención nacional diseñado por los ministerios de salud.
Referencias
Allain, J. P., & Goodrich, R. (2017). Pathogen reduction of whole blood: utility and feasibility. Transfusion Medicine, 27(5), 320–326. https://doi.org/10.1111/tme.12456
Armbruster, D. A., & Pry, T. (2008). Limit of blank, limit of detection and limit of quantitation. The Clinical Biochemist. Reviews, 29 Suppl 1, S49-52. http://www.ncbi.nlm.nih.gov/pubmed/18852857
Bah, A., Cardoso, M., Seghatchian, J., & Goodrich, R. P. (2018). Reflections on the dynamics of bacterial and viral contamination of blood components and the levels of efficacy for pathogen inactivation processes. Transfusion and Apheresis Science, 57(5), 683–688. https://doi.org/10.1016/j.transci.2018.09.004
Busch, M. P., Bloch, E. M., & Kleinman, S. (2019). Prevention of transfusion-transmitted infections. Blood, 133(17), 1854–1864. https://doi.org/10.1182/blood-2018-11-833996
Chaitanya Kumar, I., Babu, Bs., & Sreedhar Babu, K. (2020). Nucleic acid amplification testing – A paradigm shift. Journal of Clinical and Scientific Research, 9(1), 50. https://doi.org/10.4103/JCSR.JCSR_97_19
Custer, B., & Hoch, J. S. (2009). Cost-Effectiveness Analysis: What It Really Means for Transfusion Medicine Decision Making. Transfusion Medicine Reviews, 23(1), 1–12. https://doi.org/10.1016/j.tmrv.2008.09.001
Duarte, J., Álvarez, A. M., Rodríguez, S. L., Ríos, A. M., Barrera, J. A., & Cuéllar, A. (2015). Cifras e indicadores del sistema de salud. 44–45. https://www.minsalud.gov.co/sites/rid/Lists/BibliotecaDigital/RIDE/INEC/ACEMI/salude_en_cifras-2013.pdf
Fiedler, S. A., Oberle, D., Chudy, M., Scheiblauer, H., Henseler, O., Halbauer, J., Heiden, M., & Funk, M. (2019). Effectiveness of blood donor screening by HIV, HCV, HBV‐NAT assays, as well as HBsAg and anti‐HBc immunoassays in Germany (2008–2015). Vox Sanguinis, 114(5), 443–450. https://doi.org/10.1111/vox.12770
Foster, K. R., Vecchia, P., & Repacholi, M. H. (2000). Science and the Precautionary Principle. Science, 288(5468), 979–981. https://doi.org/10.1126/science.288.5468.979
Hans, R., & Marwaha, N. (2014). Nucleic acid testing-benefits and constraints. Asian Journal of Transfusion Science, 8(1), 2. https://doi.org/10.4103/0973-6247.126679
Higuchi, R., Dollinger, G., Walsh, P. S., & Griffith, R. (1992). Simultaneous Amplification and Detection of Specific DNA Sequences. Bio/Technology, 10(4), 413–417. https://doi.org/10.1038/nbt0492-413
Kim, M. J., Park, Q., Min, H. K., & Kim, H. O. (2012). Residual risk of transfusion-transmitted infection with human immunodeficiency virus, hepatitis C virus, and hepatitis B virus in Korea from 2000 through 2010. BMC Infectious Diseases, 12(1), 160. https://doi.org/10.1186/1471-2334-12-160
Klein, H. G., Hrouda, J. C., & Epstein, J. S. (2017). Crisis in the Sustainability of the U.S. Blood System. New England Journal of Medicine, 377(15), 1485–1488. https://doi.org/10.1056/NEJMsb1706496
Kleinman, S. (2021). Blood donor screening: Laboratory testing (Topic 7946 Version 57; UpToDate).
Leach Bennett, J., & Devine, D. V. (2018). Risk-based decision making in transfusion medicine. Vox Sanguinis, 113(8), 737–749. https://doi.org/10.1111/vox.12708
Leparc, G. F. (2015). Safety of the Blood Supply. Cancer Control, 22(1), 7–15. https://doi.org/10.1177/107327481502200103
Maghsudlu, M., Eshghi, P., Amini Kafi-Abad, S., Sedaghat, A., Ranjbaran, H., Mohammadi, S., & Tabatabai, S. M. (2021). Blood supply sufficiency and safety management in Iran during the COVID-19 outbreak. Vox Sanguinis, 116, 175–180. https://doi.org/10.1111/vox.13012
Mine, H., Emura, H., Miyamoto, M., Tomono, T., Minegishi, K., Murokawa, H., Yamanaka, R., Yoshikawa, A., & Nishioka, K. (2003). High throughput screening of 16 million serologically negative blood donors for hepatitis B virus, hepatitis C virus and human immunodeficiency virus type-1 by nucleic acid amplification testing with specific and sensitive multiplex reagent in Japan. Journal of Virological Methods, 112(1–2), 145–151. https://doi.org/10.1016/S0166-0934(03)00215-5
Panhotra, B. R., Hassan, Z. U., Joshi, C. S., & Bahrani, A. (2005). Visual Detection of Multiple Viral Amplicons by Dipstick Assay: Its Application in Screening of Blood Donors a Welcome Tool for the Limited Resource Settings. Journal of Clinical Microbiology, 43(12), 6218–6219. https://doi.org/10.1128/JCM.43.12.6218-6219.2005
Roth, W. K. (2019). History and Future of Nucleic Acid Amplification Technology Blood Donor Testing. Transfusion Medicine and Hemotherapy, 46(2), 67–75. https://doi.org/10.1159/000496749
Roth, W. K., & Seifried, E. (2002). The German experience with NAT. Transfusion Medicine, 12(4), 255–258. https://doi.org/10.1046/j.1365-3148.2002.00383.x
Roth, W. K., Weber, M., & Seifried, E. (1999). Feasibility and efficacy of routine PCR screening of blood donations for hepatitis C virus, hepatitis B virus, and HIV-1 in a blood-bank setting. The Lancet, 353(9150), 359–363. https://doi.org/10.1016/S0140-6736(98)06318-1
Saiki, R. K., Scharf, S., Faloona, F., Mullis, K. B., Horn, G. T., Erlich, H. A., & Arnheim, N. (1985). Enzymatic Amplification of β-Globin Genomic Sequences and Restriction Site Analysis for Diagnosis of Sickle Cell Anemia. Science, 230(4732), 1350–1354. https://doi.org/10.1126/science.2999980
Schmidt, M., & Seifried, E. (2010). Improving blood donor screening by nucleic acid technology (NAT). ISBT Science Series, 5(n1), 219–229. https://doi.org/10.1111/j.1751-2824.2010.01410.x
Silvergleid, A. J. (2021). Leukoreduction to prevent complications of blood transfusion (Version 18.0; EMB. Topic: 7935). https://www-uptodate-com.aure.unab.edu.co/contents/leukoreduction-to-prevent-complications-of-blood-transfusion/
Stramer, S. L., & Galel, S. A. (2017). Infectiuos Disease Screening. In M. K. Fung, A. F. Eder, S. Spitalnik, M. K. Westhoff, Connie M.Fung, A. F. Eder, S. Spitalnik, & C. M. Westhoff (Eds.), Technical Manual (19th Ed, pp. 161–205). AABB.
Velati, C. (2010). Occult B hepatitis – still a risk for transfusions? ISBT Science Series, 5(n1), 73–76. https://doi.org/10.1111/j.1751-2824.2010.01398.x
Velati, Claudio, Romanò, L., Piccinini, V., Marano, G., Catalano, L., Pupella, S., Facco, G., Pati, I., Tosti, M. E., Vaglio, S., Grazzini, G., Zanetti, A., & Liumbruno, G. M. (2018). Prevalence, incidence and residual risk of transfusion-transmitted hepatitis C virus and human immunodeficiency virus after the implementation of nucleic acid testing in Italy: a 7-year (2009-2015) survey. Blood Transfusion = Trasfusione Del Sangue, 16(5), 422–432. https://doi.org/10.2450/2018.0069-18
Vera Cala, L. M., Cortés Aguilar, A., Estrada Cañas, I., Serrano Gómez, S. E., & Meneses Amaya, C. P. (2018). Costo-utilidad de la adición de pruebas de Amplificación de Ácidos Nucleicos (NAT) para la detección de VHB, VHC y VIH al tamizaje convencional de las donaciones de sangre en Colombia.
WHO. (2012). Blood Donor Selection. Guidelines on Assessing Donor Suitability for Blood Donation (First Edit). World Health Organization.
WHO. (2021). Guidance on centralization of blood donation testing and processing (Department of Health Products Policy and Standards (ed.); 1er Ed). World Health Organization (WHO).
World Health Organization. (2010). Screening donated blood for transfusion-transmissible infections: recommendations (WHO Editores (ed.); 1a Edición). WHO.
World Health Organization. (2016). WHO guidelines on estimation of residual risk of HIV, HBV or HCV infections via cellular blood components and plasma (Expert Committee on Biological Standardization).
World Health Organization. (2017). WHO Expert Committee on Biological Standardization, sixty-seventh report (Sixty-seventh report; WHO Technical Report Series;1004). World Health Organization.
Yonemura, S., Doane, S., Keil, S., Goodrich, R., Pidcoke, H., & Cardoso, M. (2017a). Improving the safety of whole blood-derived transfusion products with a riboflavinbased pathogen reduction technology. Blood Transfusion, 15(4), 357–364. https://doi.org/10.2450/2017.0320-16
Yonemura, S., Doane, S., Keil, S., Goodrich, R., Pidcoke, H., & Cardoso, M. (2017b). Improving the safety of whole blood-derived transfusion products with a riboflavinbased pathogen reduction technology. Blood Transfusion, 15(4), 357–364. https://doi.org/10.2450/2017.0320-16
Redactado por:

José Arnulfo Pérez C. MD. PhDBA (c). MHA. MTACT.
Candidate of Doctor degree of Business Administration
Universitat Autònoma de Barcelona. Catalunya, España.
Linkedin José Arnulfo